本文节选自 达索系统Medidata咨询顾问朱鸣先生在CMAC监管科学与注册事务论坛:推动以患者为中心以临床价值为导向的新药上市申报中的精彩演讲——《eCOA/ePRO 在以患者为中心的临床试验新时代中的技术考量和应用》
近两年,国家药监局药审中心(CDE)就eCOA的应用多次发布相关指导原则:
2021年11月15日,CDE 发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》肯定了在肿瘤患者中收集PRO数据,可以提供无法从其他指标或终点中获得的临床重要信息;同时鼓励研究单位和申请人开发验证患者、终点和探索性终点,报告结局评估终点等。
2021年12月27日,CDE发布《患者报告结局在药物临床研发中应用的指导原则(试行)》,在肯定与纸质的PRO相比,ePRO在数据收集的高效性、实时性和灵活性、依从性、安全性和患者隐私保护等具有明显的优势之外,第一次就患者报告结局测量量表的研发、翻译、改进作了以下明确的规定:
- 如果已有公认的适合研究项目的中文量表,在获得版权后可以直接使用;
- 如果已有公认的适合研究项目的外文量表,则需要在研发形成正式的中文版本后使用;
- 如果已有量表并不完全适合研究项目时,需改进后使用。
在已有的成熟量表中如何选择更适合于拟开展的研究项目,需要考虑其科学性和可操作性。
除此之外,该指导原则提出量表作为PRO测量工具应具有良好的度量性能,应既可靠又有效。
从COA到eCOA
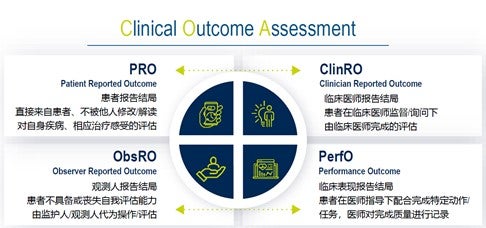
COA分类
从纸质到电子,eCOA的优势体现在从患者体验、数据的科学性以及试验运营成本几个方面,eCOA的应用有助于提高临床试验的效率,改善数据质量。
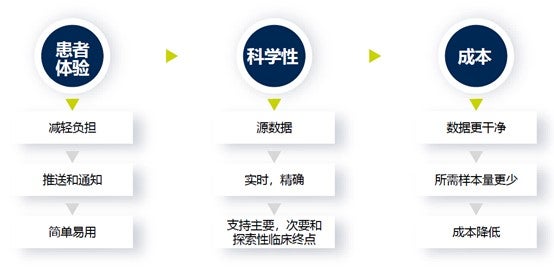
优势之外,eCOA的应用仍有许多注意事项。
eCOA应用面临的挑战
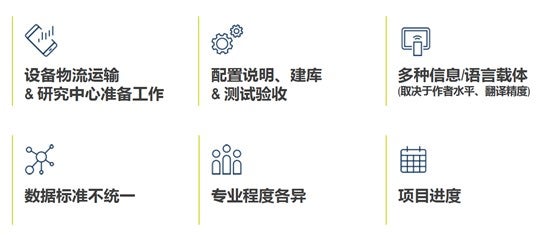
设备:是否需要定制化的设备?与设备相关的物流运输工作如何安排?如果研究中心并没有接触过电子的设备,是否需要对研究中心的工作人员来进行一定程度的培训?另外电子化的产品,其配置,建库、测试验收是否也需要相应的培训;
量表:目前来说,量表以英文为多,如果要做一个中国本土的研究,是否翻译成中文?或者如果是一个国际多中心的试验,需要多种语言的本土化方便我们的患者去阅读和理解;
系统:不同系统,数据标准并不统一。不同的EDC,不同的eCOA,那么数据对接必然牵扯到数据集成的问题。
人员:专业程度各异,对于eCOA来说,有无过往的项目经验也会对团队内部造成不同步的情况;
项目进度:考虑到eCOA的实施,需要侧重其与以往项目管理的不同之处,从项目的进度来说,需要重点考量是否需要设置额外的步骤来确保项目进度。
试验设计阶段,对于应用eCOA的考量
实施eCOA的临床试验,在方案设计时需要特别考量的问题:
- 用户:eCOA的用户是患者,特殊人群如年老/年幼或因疾病、残障限制了动手操作能力的人群,如何帮助其完成填报?或患者阅读能力有限,该如何设计量表确保所有的患者都能准确地领悟到量表的含义?
- 功能上的限制:在功能上,需要特别注意的是eCOA并非移动版的EDC,并不具备EDC的某些功能,如复杂的自定义编程等功能。虽然从合规的角度来说,ePRO直接采集的原数据,无需SDV和数据重新比对是其优势之一;
- 方案变更:对于移动端设备来说,方案变更只对新的表单生效。假设一个疫苗的III期试验,患者需要连续14天,每天填报疫苗注射的部位是否有红肿的情况?在电子日记卡中,衡量此情况的2个问题包括疫苗接种针眼处是否有红肿以及是否出现红疹?患者每日填报后,将不能再次查看表单,直到第二天9点,当日表单再次推送。患者填报7天后,假设申办方对方案进行了变更,在该量表中添加了一个新问题,那么这个新的问题只会从第8天开始出现。也就是说,14天电子日记卡信息收集完毕后,前7天的表单与后7天的表单并不一致。
- 语言:一个国际多中心试验可能涉及5种不同的语言,那翻译如何安排?特别是牵涉到比较复杂的量表的翻译,往往需要额外的步骤;
- 测试:表单设计完成后,如何测试?由谁完成测试?
eCOA使用中的实际考量
- eCOA可通过iOS/安卓系统安装APP或网页登录
- 是否支持BYOD(患者自带设备)
- eCOA的实时数据采集和与EDC的集成问题。
- 电子设备的容灾备份问题:针对移动设备本身的意外情况,eCOA使用应考量其容灾备份能力,包括:移动设备出现黑屏情况,合格的eCOA app在移动设备重启后,患者仍能重回黑屏前填报页面继续填报,并且无需重复此前填报内容;在表单填报时出现断网情况,填报的表单数据应可保存在本地,以便再次联网后,直接重新上传;或者当出现移动端设备无法使用时,患者可借助其他设备,如电脑或平板,登录网页端填报并且数据在移动端同步。
在考量eCOA产品本身技术、设计以及使用之外,试验中eCOA技术供应商提供的配套服务也至关重要,如下图:
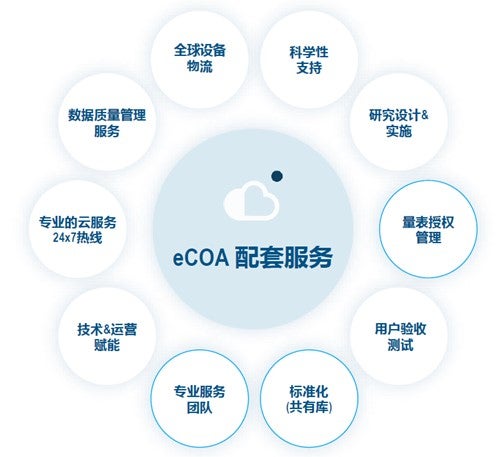
量表授权和管理支持,包括与量表作者关于版权授权、翻译等问题的沟通等。
测试和验收,eCOA作为一个新兴产品,在测试和验收上的配套服务也是一个加分项。
标准库,如果具备标准的共有库,可以在监管提交前,提前提供量表截图,以判断提前获批的可能,从整个项目的进度的角度,标准的共有库的存在将给试验运营更多缓冲时间;
本地化专业服务团队,国内专业服务团队沟通效率更高。
案例1: 在2017年到2021年,北加州大学在一项针对转移癌的研究中,实际招募患者1191名,启用50个研究中心,是中心级别的1:1的平均实验。其中25个中心采用ePRO或者是自动电话汇报形式;其余25个研究中心采用常规的医护措施。结果显示,与接受常规/标准护理的患者相比,使用了ePRO或电话汇报的患者,其整体存活率增加了5.2个月。
案例2:某药企在进行eCOA试验前,邀请12位患者代表直接参与到研究设计中,从量表的审阅界面到项目上线,全程参与,以患者视角为产品提供了全方位的用户反馈。
以患者为中心不再是一个空泛的口号,通过产品或者技术创新,真正地给予患者关怀,同时在减少患者负担的情况下,为申办方提供更多价值。
Contact Us
