
9月1日,距离新版GCP正式实施已2个月,您是否已将基于风险的监查提上议事日程?
Medidata RBQM(基于风险的质量管理)解决方案以基于风险的监查为出发点,帮助客户确定优先关注的数据指标,并通过机器学习监查关键指标,从而实现数据质量的提升。8月27日,Medidata专业服务部副总裁陈志扬博士专题分享——新版GCP下基于风险的质量管理。为您解析基于风险的监查成为新版GCP高频关键词的来龙去脉,从传统监查到中心化监查有哪些变化,以及从系统解决方案角度,如何更好的实现基于风险的质量管理。
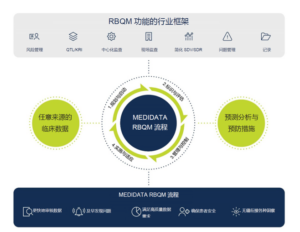
那么如何开启基于风险的监查之旅?
在Medidata最近的一项调查中,我们请受访者分享其开始实施RBM的起点(步骤)。超过一半的受访者表示以风险评估为起点,三分之一的受访者选择按风险优先级采取中心化监查方法或研究机构监查方法为起点,四分之一的受访者表示以减少 SDV 工作为起点。调查显示不同的起点步骤,其影响也各有不同:
起点:通过记录和评估风险,关注关键数据和关键流程
通过中心化记录风险评估和分类工具 (RACT)、关键风险指标 (KRI)、配置和源数据审阅 (SDR) 以及源数据核查 (SDV) 策略来获取整体、系统绑定的综合质量风险管理计划 (IQRMP)。这有助于评估研究风险的影响、概率和可检测性,是 RBM 方法中的关键步骤。
影响:遵守法规并为后续改善奠定基于风险的基础。
起点:通过一种根据风险改变的监查方式,优化研究机构的访视
此步骤能为 CRA 提供先进的用户体验和主动的决策,从而在降低风险和成本的同时,改善研究项目和研究机构的表现和患者安全,缩短产品的上市时间。这些有效的监查得益于 Medidata 采用的尖端技术,支持基于风险类别的多层监查访视、工作量的优化管理以及监查访视报告的结构化数据处理方法。无论是现场输入还是远程输入,减少多余数据的输入都能节省大量时间。
影响:提高 CRA 效率与产出,减少 CRA 流失并降低研究机构监查成本
起点:端到端问题管理通过完整审计追踪进行问题识别、调查和解决,从而评估对数据质量的影响
此步骤可确保中心化跨职能方法的实施,用于管理整个临床研究过程中的所有问题和措施。它有助于确保临床团队成员之间最大程度的协作,允许用户在风险缓解措施的实施过程中,重新指定或重复指定相关责任人,并随时添加备注信息。
影响:改进跨职能协作与检查就绪风险管理文档。
起点:通过简化的源文档验证方法,帮助 CRA 确定优先关注的数据
此步骤有助于企业减少 SDV,同时保证合规性以及数据质量战略不受影响。患者在入组时被分配到预先配置的 SDV 方案(重点关注关键数据)使研究团队能够达到预期覆盖水平。在试验进行过程中,团队可在任何级别进行修改,而不会干扰现有监查流程。
影响:节省时间并让 CRA 专注于重要事项—患者入组和改善研究机构表现。
起点:使用机器学习分析数百万的数据点,确定已知和未知风险、异常值、离群值和数值分布模式
此步骤应用复杂的机器学习算法来查询试验中临床数据的离群值、数据异常和趋势。通过即时分析临床试验的表现和数据质量,能够快速准确地确定风险领域。此外,Rave RACT 中配置的 KRI 显示为中心化仪表板的一部分,以识别风险并启动一系列纠正措施工作流程。中心化监查是专门为用于各个职能区域的中心化统计监查而设计的。
影响:以更高的效率和洞察力维护或改善数据质量。
起点可以多种多样,从何处开始并没有那么重要。对于申办方而言,最佳起点取决于当前的流程、技术与长期目标。重要的是,申办方利用行业经验判断最佳起点与实施路径,从而开启基于风险的监查之旅。
如果处理得当且认真考虑需求与目标,基于风险的监查将明显帮助改进当前监查方法。基于风险的质量管理RBQM则将给临床试验在质量、效率与成本上带来根本改变,不仅可改善特定的试验实施,并能为申办方打造战略性的持久优势,对整个临床开发生命周期都将具有持续性影响。
关联信息:
Contact Us

