从GCP新规出发,带您了解RBQM包含的临床试验监查活动

您知道吗?RBQM(基于风险的质量管理)包含哪些方面的监查活动?
1.CRA活动(减少SDV, SDR);
2.现场监查、研究中心数据;
3.中心/远程监查、数据监查/监管、数据管理、统计人员活动。
A. 1和2 B.1和3 C.2和3 D.以上都是
正确答案见文末。
新版GCP(《药物临床试验质量管理规范》)与时俱进地把握了临床试验监查数字化转型方向,提出基于风险的监查(Risk-based Monitoring, RBM)和中心化监查(Centralized Monitoring)模式。
基于风险的监查RBM是一种自适应或者可调整的临床试验监查方法,能够将监查重点和活动,导向对于受试者安全与数据质量最为需要的方面。而基于风险的质量管理(risk-based quality management,RBQM)则更为全面。开展RBQM项目必须考虑的要素,包括整体的质量把控、中心化监查以及文完整的关于质量和风险管理的文档,包括计划文档和SOP。
其中,针对监查,Medidata认为RBQM将监查工作分成了三种类型,现场监查、非现场监查、中心化监查。
不管使用RBQM与否,现场监查仍然是我们临床试验最核心的项目。现场监查之外,通过非现场监查可以做更多的补充,监查员或者是数据管理人员,每天坐在办公室电脑前面,做数据清理工作,通过运行报表、数据运算等获取每家研究机构或者参与项目中的各个角色、人员的各项绩效指标,掌握负责的研究机构的绩效表现。
在新版GCP中,引入的中心化监查,并不是集中在某一家研究机构,也不是集中在某一个CRA的表现,它考虑的是整个临床试验数据质量,从整个临床试验项目,涉及多方角色共同参与的项目,囊括不同分工角色共同参与决定,并识别临床试验的数据质量是否可靠,是否存在潜在的风险,如果有潜在的风险,能不能提前识别,这才是RBQM的核心所在。
[caption id="attachment_59316" align="alignnone" width="984"]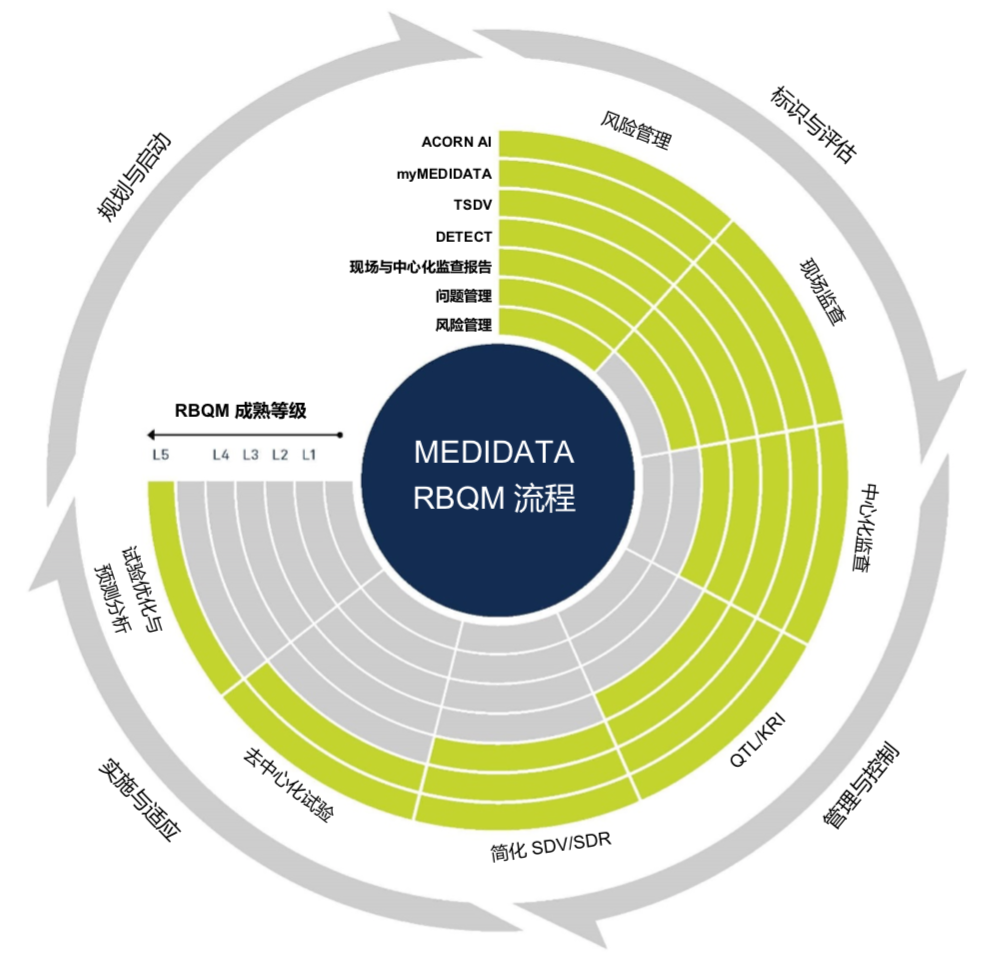 Medidata Rave RBQM 流程[/caption]
Medidata Rave RBQM 流程[/caption]
图例 L1 - 初始 L2 - 已管理 L3 - 已定义 L4 - 已衡量 L5 - 已优化
中心化监查和非现场监查,这两者是现场监查的补充,而不是替代。监查员现场监查的工作并不能因为RBQM的使用而被完全替代。目前监查员的大部分工作时间仍用于像SDV这样的重复率较高且耗时的工作,仅有约20%用于流程管理和与中心沟通。实施RBQM之后,整个监查范围将发生很大变化,监查员的工作内容会更多集中在关键数据、关键流程中。监查员的日常工作时间的分配将由此转变,真正需要去现场的时间或者是次数将明显降低,理想状况下占80%的SDV工作量可以缩减到30%以下,有些项目甚至可以缩减到5%以下。
正确答案 D
延伸阅读:新版GCP实施,Medidata助力临床试验抢占先机
Contact Us

